近日,由山东第一医科大学附属肿瘤医院(山东省肿瘤医院)乳腺内科李慧慧教授牵头开展的一项吡咯替尼联合白蛋白结合型紫杉醇一线治疗HER2+转移性乳腺癌的单臂Ⅱ期研究荣登《Clinical and Translational Medicine》(CTM,Q1区,IF=10.6)[1]。研究结果显示,在既往辅助/新辅助治疗期间接受曲妥珠单抗的HER2+转移性乳腺癌患者中,吡咯替尼联合白蛋白结合型紫杉醇作为一线治疗具有良好的疗效,客观缓解率(ORR)为92.6%,疾病控制率(DCR)为100%,中位无进展生存期(mPFS)尚未成熟,且TLR3和RET可能作为患者无进展生存的潜在预测蛋白。 该研究在2022年GBCC(全球乳腺癌学术大会)、2023年SABCS(圣安东尼奥乳腺癌研讨会)相继亮相后再传捷报,2024年5月全文发表于CTM,再次让“中国原研”和“中国之声”响彻国际学术舞台,这是首个吡咯替尼在100%曲妥经治晚期HER2+乳腺癌一线治疗的研究结果,为曲妥经治晚期乳腺癌一线治疗提供了有力证据支持,爱医时空特对本研究进行解读与分享。

研究发表于Clinical and Translational Medicine
研究背景
乳腺癌是全球女性面临的一个巨大威胁,其中人表皮生长因子受体-2过表达或基因扩增(HER2+)乳腺癌患者约占所有乳腺癌患者的25-30%[2]。HER2靶向治疗改善了HER2阳性乳腺癌患者的预后。
吡咯替尼作为一种新型不可逆酪氨酸激酶抑制剂(TKI),可强效靶向作用于EGFR/HER1、HER2和HER4。2018年,吡咯替尼凭借Ⅱ期临床研究的优异疗效被批准有条件上市。2023年10月31日,PHILA研究正式在线发表于国际四大顶级医学期刊之一——《英国医学杂志》(British Medical Journal,简称BMJ;IF=105.7)[3],这是乳腺癌领域中国自主研发药物临床研究刊登的影响因子最高的国际期刊。
吡咯替尼和白蛋白结合型紫杉醇在治疗HER2+转移性乳腺癌(MBC)中均显示出良好的疗效。然而,尚没有吡咯替尼联合白蛋白结合型紫杉醇用于既往辅助/新辅助期间接受曲妥珠单抗治疗的HER2+转移性乳腺癌患者的一线治疗的确证性研究。在治疗过程中动态检测血浆蛋白,可直观地监测治疗反应及预后,目前还没有研究探索吡咯替尼联合治疗方案的预测性蛋白标志物。
本研究旨在评估吡咯替尼联合白蛋白结合型紫杉醇一线治疗既往在辅助/新辅助治疗期间接受曲妥珠单抗治疗的HER2+MBC的有效性和安全性。蛋白组学用于探索与无进展生存期(PFS)和不良事件相关的标志物。
研究设计
该研究是一项单臂Ⅱ期临床研究(ChiCTR1900027932),纳入18-70岁女性患者,ECOG评分为0-1,既往在辅助/新辅助治疗期间接受曲妥珠单抗治疗的HER2+MBC患者。接受吡咯替尼(400 mg,po,qd)联合白蛋白结合型紫杉醇(125 mg/m2,ivdrip,d1,d8,q21d)作为一线治疗方案,其中白紫至少使用6周期,后由研究者根据患者情况及患者意愿决定是否停用白紫,吡咯替尼应用直至疾病进展、毒性不可耐受或撤回知情同意。该研究采用Simon两阶段优化研究设计,第一阶段共27例患者入组,如果超过17例患者达到完全缓解(CR)或部分缓解(PR)(ORR≥63%)并证实有良好的安全性,则继续增加至67例患者进入第二阶段研究,考虑15%的脱落率,共计需要入组79例患者。主要研究终点为ORR,次要研究终点为无进展生存期(PFS)、总生存期(OS)、DCR及安全性。利用Olink蛋白组学平台动态采集血液样本,探索预测生物标志物。

图1. 研究设计
研究结果
患者基线
2019年12月至2023年8月期间,共筛选30例患者,27例符合条件纳入疗效和安全性分析(图2),48.1%(n=13)有内脏转移,44.4%(n=12)有非内脏转移,7.4%(n=2)有无症状脑转移。此外,40.7%(n=11)为激素受体阳性,其中10例曾接受过辅助内分泌治疗,所有患者均完成辅助化疗,29.6%(n=8)未能完成1年的曲妥珠单抗治疗,4例患者在至少接受曲妥珠单抗治疗6个月后出现疾病进展,4例因依从性差而停止治疗。23例接受曲妥珠单抗单靶治疗,仅有4例接受曲帕双靶治疗。据完成曲妥珠单抗辅助治疗结束到疾病进展的时间是否超过12个月,15例为曲妥珠单抗原发性耐药组,12例为继发性耐药组(图2右)。

图2. 研究流程图(左)和患者基线特征表(右)
临床疗效及安全性
截至2023年8月,中位随访时间为17.8个月,对27例患者进行疗效评估,其中7例达到CR,18例PR,2例疾病稳定(SD)。ORR为92.6%,DCR达100%(图3),中位PFS尚未达到,1年OS率为94.4%。与非内脏转移患者相比,内脏转移患者PFS更短(P=0.002)(图4D),3级及以上不良反应依次为腹泻、中性粒细胞减少、白细胞减少、口腔黏膜炎和手足综合征。

图3. 与基线相比,肿瘤靶病变直径总和的最大变化
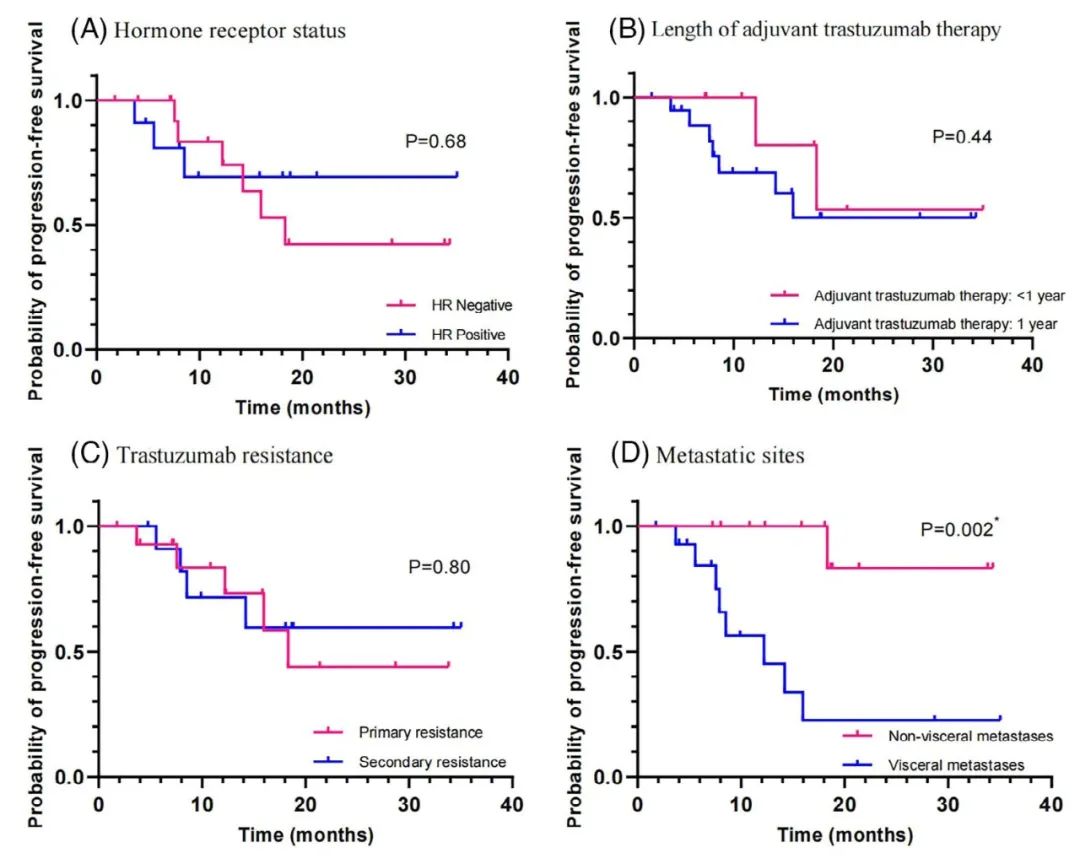
图4. 生存分析:(A)激素受体状态;(B)辅助曲妥珠单抗治疗时长;(C)曲妥珠单抗药性;(D)转移部位
生物标志物
采集21例患者基线和第二周期治疗前的血液样本进行蛋白组学分析,其中7例疾病进展时采集了血液样本。在整个治疗过程中,与基线相比,23种蛋白在第二周期治疗前下调,其中CEACAM5最为显著,其次是PVRL4、ERBB2、ITGAV和ITGB5;22种蛋白在进展中下调,其中CEACAM5最为显著,其次是PVRL4、TXLNA和ERBB2(图5A、图5B)。

图5. (A)第二周期治疗前和基线之间的动态蛋白质组学分析;(B)进展和基线之间的动态蛋白质组学分析
研究发现,基线水平的RFT和TLR3蛋白与患者的PFS显著相关(图6)。进一步分析显示,基线时TLR3高表达(图7A)和RET低表达(图7B)的患者具有更长的PFS。

图6. 生存相关的蛋白组学分析

图7. TLR3(A)和RET(B)的KM生存分析
与Ⅰ、Ⅱ级腹泻患者相比,Ⅲ级腹泻患者在基线时有6种蛋白上调,其中CRNN是最重要的蛋白(图8)。

图8. 蛋白整体表达的热图
讨 论
自曲妥珠单抗上市抗HER2治疗取得长足进展,随着越来越多的抗HER2药物问世,进一步探索联合治疗策略及识别与治疗相关的生物标志物尤为重要。在这项Ⅱ期研究中,吡咯替尼联合白蛋白结合型紫杉醇作为一线治疗方案ORR达到92.6%,超越了PANDORA研究[4]中吡咯替尼联合多西他赛的ORR(79.7%),CLEOPATRA研究[5]中的双靶向治疗+多西他赛的ORR(80.2%),以及PHILA研究[3]中的吡咯替尼+曲妥珠单抗+多西他赛的ORR(82.8%),且和PHILA研究及PANDORA研究既往接受曲妥珠单抗辅助和/或新辅助治疗亚组分析趋势一致,证明吡咯替尼联合白蛋白结合型紫杉醇作为既往接受曲妥珠单抗辅助和/或新辅助治疗的患者一线治疗方案具有良好的疗效,且安全可耐受。
在治疗过程中,CEACAM5、TXLNA、PVRL4和ERBB2蛋白表达下调最为显著,进一步探索CEACAM5、TXLNA、PVRL4和ERBB2变化的可能机制,有助于更好地理解吡咯替尼治疗乳腺癌耐药的机制。基线时TLR3高表达和RET低表达的患者PFS较长。
腹泻是TKI一种常见的不良事件,而TKI诱导腹泻的机制尚不清楚,可能包括离子转运失调、黏膜损伤和炎症等多个因素。结果显示,与Ⅰ级和Ⅱ级腹泻患者相比,Ⅲ级腹泻患者的CRNN在基线时显著上调。而迄今为止,CRNN没有报道与TKIs或腹泻有任何关联。因此需进一步探索研究中蛋白组学发现的潜在机制。
同时,该研究存在入组患者较少和未设置对照组单臂设计的局限性。应纳入更多患者,进一步确证研究结果。
研究结论
研究表明,吡咯替尼联合白蛋白结合型紫杉醇作为既往接受辅助和/或新辅助曲妥珠单抗治疗的HER2+转移性乳腺癌患者一线治疗方案,具有良好的疗效和可控的安全性。生物标志物的分析结果提示,TLR3和RET可能作为这类患者无进展生存的潜在预测蛋白。需要更大样本的队列研究进一步验证该研究结果,并阐明差异蛋白和生存相关蛋白的潜在机制。










































